下面我们一起跟着锦秋回顾下爱德思考试局2021年10月考试季,A-Level化学U2考情解析!
A-Level化学U2/2021年10月考题分析
考试日期:2021年10月8日
考试时长:1小时30分
考试题目:共计22道
Q1
B红外光谱题。由数据册可知,2900左右的强吸收应为烷烃中C-H键,既没有3000+的O-H宽峰,也没有1700左右的C=O强峰,只能是烷烃。
Q2
D 醇的反应题。叔醇(tertiary alcohol)、酮(aldehyde)和羧酸(carboxylic acid)不会被进一步氧化 。
Q3
A有机分子式题。把结构画出来即可。
Q4
D(有机)质谱题。分子离子峰不一定是最 高(最 多)的,但一定是最重的。
Q5
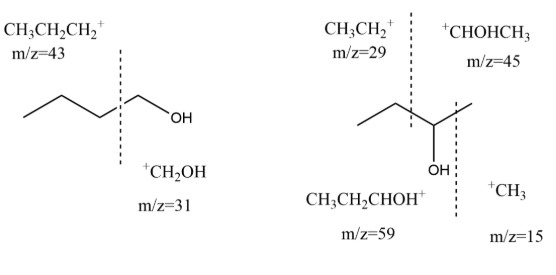
C(有机)质谱题。需先将二者分子式画出来,遵循“C-O旁的键易断开”的原则。
Q6
A 熔沸点判定题。首先需要数一下原子个数,确定各选项是同分异构体的关系之后就看谁的侧链少就可以了,没有侧链的表面积会比较大,与相邻分子的接触机会更多,形成的伦敦色散力更强。
Q7
有机反应题。
(a) A 加成反应,反应条件为氢气和镍金属催化。
(b) C 还原反应,氧化的逆过程,在四单元中会学到此反应条件为在干醚溶剂中的四氢铝锂(LiAlH4)。
Q8
D 极化作用--热稳定性题。阳离子对阴离子的极化作用越强阴离子越容易热分解,而极化作用与阳离子电荷正相关,与阳离子体积负相关。
Q9
D 基本方程式运算题。2×10-3mol的丙醇燃烧生成6×10-3mol二氧化碳。
Q10
氧化还原题。
(a) C 氧化还原方程式配平,因为大部分氧化还原剂和氧化还原产物的化学计量数已经给了,而且每一个需配平的物质都有独特的原子,使得这个题还是比较简单。左侧草酸的化学计量数依照右侧二氧化碳的10配平为5,左侧硫酸依照右侧硫酸根离子配平为10,右侧水依照左侧氢原子配平为8.
(b) B 草酸根离子(C2O42-)中碳原子应为+3价;二氧化碳中碳原子为+4价。
Q11
C 氧化还原题。氧原子除了氧气中的0价和双氧水中的-1价,一般都是-2价。
Q12
B 氧化还原题。B选项是酸碱中和反应,中和反应都是非氧化还原。
Q13
C 溶液计算题。将1mol dm-3的溶液稀释至0.05mol dm-3是稀释二十倍,溶质的量不变;稀释后总体积0.25cm-3×1mol dm-3÷0.05mol dm-3=0.5dm3=500cm3;需加水500cm3-25cm3=475cm3。
Q14
B 卤素题。卤素的基本性质,单质氧化性由上到下递减。
Q15
A 卤素题。溴和碘单质溶于有机溶剂时会显现出其本身的颜色,只有在溶于水这样的极性溶剂时才会由于溶剂化效应都变为棕黄色。
Q16
C 分子间作用力题。非常典型的氮族、氧族、卤素氢化物熔沸点“√图”题目,氟化氢熔沸点最 高因为其有氢键,氯化氢、溴化氢、碘化氢三者递增因为分子中电子数目递增,伦敦色散力递增。
Q17
C 卤素题。卤素阴离子还原性随周期表自上而下递增:氯离子无法还原硫酸;溴离子可将硫酸还原为二氧化硫;只有碘离子才有足够强的还原性,可将硫依次还原为二氧化硫、硫单质和硫化氢。
Q18
B 基本方程式计算题。无水硫酸镁相对分子质量120.4g mol-1;七水合硫酸镁与无水硫酸镁物质的量相同。
Q19
(a) 焓变测定题。注意结果一般保留三位有效数字,为了保证最终结果第三位是正确的,计算过程中建议保留四位(或以上)。
(i) nethanol=1.19g÷46g mol-1=0.02587mol
(ii) ΔT=42.3℃
Q=mcΔT=100g×4.18J g-1 ℃-1×42.3℃=17681.4J=17.6814kJ
(iii) ΔH=Q÷nethanol=17.6814kJ÷0.02587mol=683kJ mol-1
(iv) 除了热损失之外解释结果不准确的原因,对于一个燃烧反应焓变测定来说一般有:燃料挥发ethanol is volatile;各物质,特别是作为产物的水不是标况下的液态water product is not under standard condition。
(b) 键焓题。
(i) 名词解释“平均键焓”:the mean energy need to break 1mol of covalent into gaseous atoms.
(ii) 键焓计算,想起来有困难或者出于保险起见的话可以先将各物质展示式写出来。ΔH=413*3+358+464+1.5*498-805*2-464*4=-658kJ mol-1。
(c) 盖斯循环题。首先写出已知的各焓变对应方程式:

再将各方程式构建为首尾相接的盖斯循环:
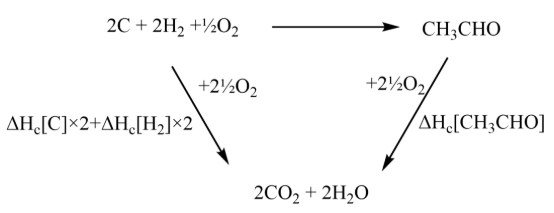
构建盖斯循环的重点是将已知的方程式首尾相接,而不是凭空去找中间物。
最后按照“始末状态相同焓变即一致”原则计算即可:
ΔH=-394*2+(-286)*2-(-1167)=-193kJ mol-1。
Q20
(a) 卤代烃水解反应速率题。
(i) 量度水解反应速率是通过其水解产物卤化氢与硝酸银生成沉淀的时间来量度,生成沉淀时间越短水解反应越快:measure time for precipitate formed。
(ii) 氯代烃、溴代烃、碘代烃中碘代烃水解最快,因为C-I键最长最易断开:1-iodopropane is the fastest; C-I bond is the longest and weakest。
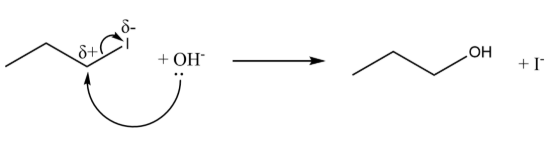
(b) 亲核取代机理题。此处实际只能以SN2机理进行,SN1一般也会给分:
(c) 分子间作用力题。虽然此三者皆为极性分子,但比较熔沸点时无需考虑取向力(dipole-dipole interaction),只考虑伦敦色散力即可:increasing number of electrons with increasing atomic number(for Cl, Br and I); stronger London force; although polarity of molecules decreasing; dipole-dipole interaction is not predominate。
(d) 卤代烃消除反应题。氢氧化钾醇溶液是卤代烃消除反应的条件,对于2-溴丁烷来说,消除反应可向两侧进行,另外不要忘记几何异构:but-1-ene; E-but-2-ene; Z-but-2-ene。
Q21
(a) 碱金属题。
(i) 钾金属与水反应的方程式:2K(s) + 2H2O(l) → 2KOH(aq) + H2(g)
(ii) 钾金属被氧化:K is oxidised form 0 to +1;水中的氢被还原:H is reduced form +1 to 0。
(iii) 钾金属的焰色为浅紫色/丁香色:lilac
(b) 滴定题。
(i) 滴定终点时溶液由碱性变为中性:(phenolphthalein) from pink(purple) to pale pink
(ii) 推断M金属身份,即由其相对原子质量判断。首先计算M金属也就是溶液中MOH物质的量:nMOH,25=c*V=0.4mol dm-3×12.8cm3=0.00512mol; nM=nMOH,250=0.0512mol
再计算其相对原子质量:MM=m÷n=0.37g÷0.0512mol=7.23g mol-1; M is Li。虽然结果与锂的相对原子量有偏差,但由于题干中说了是1主族金属,所以只能是锂。
如果不把油擦掉的话秤出的M金属质量将会偏大,造成相对原子质量偏大:the mass of metal would be higher; lead to higher relative mass of M。
Q22
(a) 生物燃料题。阐述生物乙醇的优缺点。优点主要集中在可持续/碳中性方面:the fuel is sustainable/carbon neutral;缺点一般答占地/减少食用粮食等方面:the production of bioethanol occupy land/decrease the edible crops。
(b) 与生物相关的常识题。为何发酵过程隔绝空气。微生物有氧呼吸会产生完全氧化产物二氧化碳和水,只有无氧呼吸才会产生醇类:in presence of air/O2 (will lead to aerobic respiration) produce CO2 and water/ only anaerobic respiration could produce alcohol。
(c) 分离发酵产物中醇的方法。发酵产生的纯一般通过蒸馏提纯,也是高度酒精饮料的常用处理方式:distillation。
(d) (i) 解释乙醇吸水原理。乙醇吸水的原理与其和水任意比例混溶的原理相同:ethanol can form strong hydrogen bond with water。
(ii) 解释乙醇燃料吸水的后果:hard to ignite/incomplete combustion....。
(e) (i) 小拼大型六分大题。解释乙烯加水反应的工业条件选择。此类题目需从题干入手,此题中阐述了温度压力催化剂三方面,且温度压力需分别考虑更高和更低的影响:①higher temperature lead to lower yield; ②due to (the forward reaction) exothermic; ③low temperature lead to slower reaction rate; ④higher pressure lead to higher cost/safety problem(although yield would also be higher);⑤ lower pressure lead to lower yield an reaction rate; ⑥ phosphoric acid catalyst can increase reaction rate (so lower temperature and pressure needed);⑦compromise had to be made when selecting temperature and pressure。
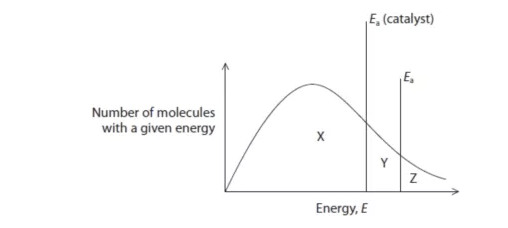
从玻尔兹曼分布图中表示催化剂对反应速率的影响。首先图总的横坐标为分子动能Ek(也可写作分子运动速率);纵坐标为分子数量:number of molecules(实际上是分子的概率分布);然后画两条竖线分别表示加入催化剂前的活化能Ea和加入催化剂后的活化能Ea’即可;最后阐述降低活化能可使得更多分子能够参与反应lower the activation energy will allow more molecules have enough energy to react。
(f) (i) 解释催化剂的支撑材料多孔的原因,固定答案增加表面积: increasing surface area。
(ii) 在此种情况下仅有5%的乙烯被转换为乙醇,问如何提高总体产率。此题类似氨的哈珀合成法,即分离产物中未反应的反应物并再次投入反应:recycle the unreacted reactant and used into synthesis again。
本文作者:锦秋A-Level化学组 柴国豪